Aplicații ale reacțiilor redox
Pila Daniell
Pila Daniell este formată din două semicelule, un electrod de zinc cufundat în soluția unei sări de Zn şi unul de cupru cufundat în soluția unei sări de Cu.
Electrodul pe care are loc un proces de oxidare se numeşte anod. Electrodul pe care are loc un proces de reducere se numeşte catod.
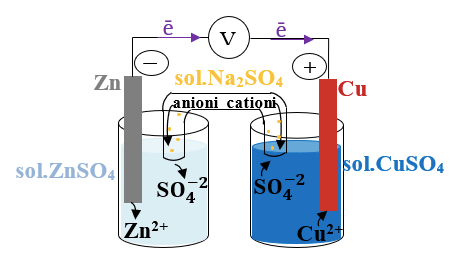
Atomii de zinc se oxidează mai uşor, ei cedează electroni mai ușor decât atomii de cupru şi trec în soluţie ca ioni de Zn2+. Electronii cedaţi se acumulează pe placa de zinc, de unde migrează, prin firul conductor, pe placa de cupru.
Zn0 → Zn+2 (reacție de oxidare A.R.= Zn)
Ionii de Cu2+ au tendinţa de a se reduce, ei accepta electronii. De aceea, electronii de pe electrodul de Cu vor fi acceptaţi de ionii Cu2+, care trec în atomii de cupru şi se depun pe placa de cupru.
Cu+2 → Cu0 (reacție de reducere A.O.= CuSO4)
